Менделеев
В России о «горькой» ходит много легенд. Один из мифов указывает на связь появления водки с деятельностью Д.И. Менделеева. Основанием послужила его докторская диссертация, которая называлась «О соединении спирта с водой».
О, эта формула водки Менделеева! Какая же она на самом деле? В мифе рассказывается о следующем:
Занимаясь диссертацией, ученый установил необычные свойства водно-спиртовой жидкости. Смесь имела концентрацию этанола 43% по объёму и странно воздействовала на живой организм.
С подобной концентрацией водно-спиртовую жидкость можно получить, лишь смешивая весовые части спирта и воды.
Основываясь на этих фактах, Менделеев смог разработать рецептуру под названием «Московская особенная». Этот эксклюзив в 1894 году был запатентован российским правительством как национальная русская водка.
Конечно же, Д.И. Менделеев никогда не принимал участия в создании либо модернизации водки. Лишь немногие его работы впоследствии были использованы для изготовления этой жидкости.
Кислотность спиртов
| RОН | рKa. |
| (СН3)3СОН | 18,0 |
| (СН3)2СНОН | 17,1 |
| СН3СН2ОН | 15,9 |
| СН3ОН | 15,5 |
| НОН | 15,7 |
Как проверить качество напитка
Опытные пользователи могут определить качество продукта по запаху. В недостаточно хорошо очищенных напитках содержатся сивушные масла, которые придают характерные вкусовые нотки и аромат. Однако в некоторых случаях опасные компоненты обладают приятным запахом, поэтому данный метод не является точным. Например, альдегид фурфурол, который традиционно попадает в спирт из злаковой браги, имеет аромат ржаного хлеба.
При приобретении продукта важно обратить внимание на внешний вид бутылки. На поверхности должны присутствовать этикетки и голографические знаки
Клеевой слой традиционно плотно прилегает к стеклу. Желательно приобретать одну и ту же марку, чтобы было проще отличить подделку. Ключевое значение имеет ценовая категория. Качественный очищенный этанол стоит дорого из-за особенностей технологии производства. Низкая цена может свидетельствовать об использовании технического спирта, наличии лишних примесей или повышенном содержании воды.
Для проверки качества можно интенсивно потрясти бутылку. Если в состав входит слишком много воды, пузырьки будут большими. В норме они должны быть мелкими. В качественном напитке пузырьки исчезают в течение 2-3 секунд. Недопустимо выпадение осадка, появление мутности после встряхивания или отсутствие прозрачности еще до проведения манипуляций.
В лабораторных условиях проверить химический состав водки можно с помощью оборудования. Ареометр позволяет определить фактическую крепость напитка. Косвенно о концентрации этилового спирта свидетельствует вес продукта. При стандартной крепости (40%) масса 1 л водки должна составлять 953 г. Допускается незначительное отклонение (5 г) в большую или меньшую сторону. При взвешивании необходимо учитывать вес тары.
Наличие кислот в напитке можно определить с помощью лакмусовой бумаги. В домашних условиях ее можно заменить луковой шелухой. При повышенной концентрации кислот она окрашивается в алый цвет. Также при погружении в некачественный напиток изменится оттенок лепестков василька.
Проверку можно провести с помощью температурного воздействия. Самый простой способ — заморозка. При температуре -20°C качественный продукт должен оставаться жидким. Если напиток частично или полностью превращается в лед, он содержит сторонние примеси. Чем сильнее замерзает жидкость, тем больше лишних веществ в ней присутствует.
В домашних условиях можно попытаться поджечь жидкость
Это следует делать осторожно, чтобы избежать пожара. Достаточно налить слегка нагретую водку в небольшую пробку и поднести источник огня
Качественный продукт начнет гореть. Пламя должно быть ровным и слегка синеватым. При наличии примесей жидкость либо не загорится, либо вспыхнет ненадолго, либо будет потрескивать при горении и издавать неприятный запах, характерный для сивушных масел.
В лабораторных условиях для оценки качества можно использовать реагенты. Для выявления метилового спирта добавляют несколько кристаллов марганцовки. Если в продукте содержится чистый этанол, в ходе реакции появится специфический запах уксуса. При наличии метанола образуется углекислый газ. Также можно опустить в жидкость нагретую медную проволоку. Если в напитке присутствует метиловый спирт, возникнет запах формалина.
Для того чтобы определить содержит ли продукт, находящийся перед вами в своем составе метиловый спирт, довольно просто. Существуют методики, которые можно повторить только в условиях лаборатории или в домашних условиях.
Находясь в лабораторных условиях, жидкость нагревают до определенной температуры. От этой температуры и зависит результат. Температура кипения этилового спирта составляет семьсот восемьдесят градусов Цельсия, в отличие от него метил закипает при шестистах сорока.
В домашних условиях в небольшую емкость с подозрительной жидкостью можно добавить пару гранул марганцовки. Если в напитке содержится этил, то появится ярко выраженный запах уксуса. Если в растворе содержится метанол, то в емкости появятся пузырьки газа. Помимо этого, можно пару раз встряхнуть бутылку с жидкостью. В напитке, отвечающем всем стандартам качества, пузырьки воздуха исчезают за две секунды.
Эти несложные методы позволяют определить качество напитка, находящегося перед вами. Они позволяют обезопасить себя от развития возможных последствий, в результате употребления поддельной продукции
Именно поэтому очень важно уметь определять качество водки «на глаз» с помощью последнего метода.
Из каких кислот состоит царская водка
Альдегиды и кетоны
Как в альдегидах, так и в кетонах sp2-гибридизованный атом углерода связан двойной связью с атомом кислорода. Три сигма (σ)-связи, соединяющие атом углерода с углеводородным радикалом, атомами водорода и атомом кислорода в молекуле альдегида и с двумя углеводородными радикалами и атомом кислорода в молекуле кетона, находятся в одной плоскости. Углы между связями состав-ляют примерно 1200. π-связь имеет две доли: одна располагается выше, а другая ниже этой плоскости. На рис. представлено образо-вание π-связи между атомами углерода и кислорода.
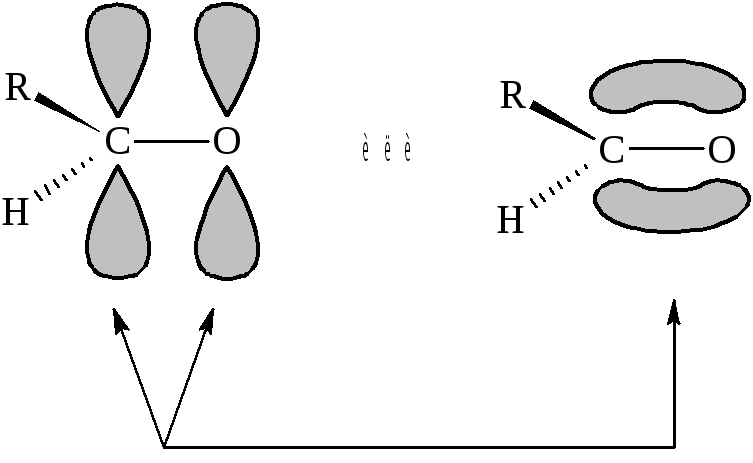
p-орбитали при боковом перекрывании образуют π-связь
Альдегидная группа (HCO) обуславливает наркотическое действие и дезинфицирующие свойства. Карбонильную группу содержат в своем соста-ве многие биоорганические соединения, которые участвуют во многих мета-болических процессах (моносахариды, олигосахариды, оксокислоты, актив-ная форма витамина В6 – пиридоксаль, кофермент пиридоксальфосфат).
Прямое галогенирование алканов редко используется для полу-чения алкилгалогенидов. Во-первых, этот метод может исполь-зоваться только для получения хлоридов и бромидов, а фториды и иодиды не могут быть получены таким образом. во-вторых, хлори-рование, как правило, протекает неселективно и помимо относи-тельно невысокого выхода желаемого хлорида, возникает проблема разделения измерных хлоралканов, которые часто мало отличаются по своим физическим свойствам (например по температурам кипения). Таким образом, единственным практически пригодным методом, но и то только для получения третичных бромидов, остается бромирование алканов, содержащих третичный атом углерода. Это связано с очень большой разницей в скоростях бромирования по первичному, вторичному и третичному атому углерода.
Галогеноводороды присоединяются к алкенам, причём реакции-онная способность галогеноводородов возрастает от HCl к HJ. Направление присоединения HHal (Hal галоген) к несимметрично замещённым алкенам (монозамещённым и 1,1-дизамещённым) опре-деляется правилом Марковникова: водород из HHal присоединяется к наиболее гидрогенизированному атому углерода алкена, т.е. тому атому углерода, который связан с большим числом атомов водорода.
Известно много способов замены гидроксильной группы спирта на галоген. Эти методы замещения гидроксила на галоген основаны на реакции спиртов с галогеноводородами, а также с галогенидами фосфора и оксогалогенидами фосфора и серы. Все эти методы подробно разбираются в разделе «Спирты».
Образование связей С–N, C–S, C–O, и С–С в приведённых выше реакциях осуществляется за счёт неподелённой пары электронов соответствующего реагента, а разрыв связи С–Hal происходит таким образом, что пара электро-нов полностью переходит к галогену, который уходит в виде аниона. Реаген-ты, образующие связь с субстратом за счёт собственной пары электронов, называются нуклеофильными, а рассмотренные выше реакции – реакциями нуклеофильного замещения у насыщенного атома углерода.
В общем виде эти реакции могут быть описаны следующей схемой:
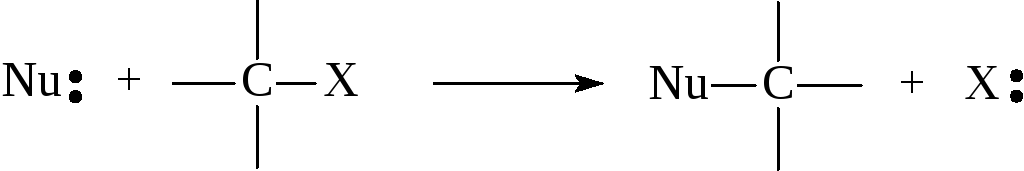
где Nu: - нуклеофильный реагент, а X – уходящая группа; нуклеофильный реагент может быть как отрицательно заряженным, так и нейтральным. Изучение нуклеофильного замещения у насыщенного атома углерода сыграло важную роль в развитии представлений о механизме органических реакций. Основные представления о механизме нуклеофильного алифатического замещения были сформулированы в 30-40 годах прошлого века, а впоследствии они были существенно модифицированы.
Во всех, приведённых выше реакциях, присоединение происходит однотип-но, углеводородный радикал из RMgX присоединяется к атому углерода карбонильной группы, а MgX к кислороду, с образованием в качестве промежуточного продукта смешанного алкоголята, гидролиз которого в кислой среде даёт соответствующий спирт.
Скорость гидролиза алкилгалогенидов (RX) возрастает при переходе от хлоридов к иодидам, а гидролиз может протекать как в нейтральной, так и в щелочной среде. В случае третичных галогенидов возможно образование алкенов в качестве побочных продуктов.
Что касается состава царской водки, оказалось, что химическая смесь соляной и азотной кислоты при взаимодействии своих компонентов усиливает свои способности в несколько раз. Смесь получилась настолько сильной, что в ней растворяется золото, и даже платина при соотношении 1:4 (соляная кислота при реакции с азотной кислотой высвобождает хлор, при этом раствор зеленеет, а частицы свободного хлора атакуют золото).
Формула взаимодействия выглядит так:• Кислота азотная окисляет кислоту солянуюHNO3 3HCl = NOCl Cl2 2H2O.• Во время этого процесса появляется два активных вещества: нитрозилхлорид и хлор, которые в состоянии растворить золото:• Au NOCl2 Cl2 = AuCl3 NO.
Хлорид золота моментально присоединяет к себе молекулу HCl, при этом образуется тетрахлорозолотая кислота, еще известна в народе как «хлорное золото»: AuCl3 HCl = H (AuCl4).
Приготовление царской водки в домашних условиях должно проходить с соблюдением всех мер безопасности и хорошо проветриваемом помещении.Чтобы приготовить царскую водку, Вам понадобиться обзавестись двумя основными ингредиентами: концентрированная соляная и азотная кислота.Так же настоятельно рекомендуем использовать только стеклянные пробирки (с отметками) и стеклянную палочку для равномерного размешивания «гремучей смеси».
Оригинальный состав представляет собой смесь двух кислот в количественном соотношении 1: 3. Смешивайте, используя только одну пробирку, не отмеряйте кислоты в других емкостях, таким образом Вы минимизируете шанс проливания кислоты. Теперь нужно обговорить по отдельности те компоненты, с которыми Вам придётся столкнуться при изготовлении царской водки.
История
Впервые царскую водку описал Псевдо-Гебер. Он был неизвестным алхимиком. Его трактаты распространялись в Европе в четырнадцатом веке. Задолго до обнаружения соляной кислоты в латинских трудах была описана химическая формула царской водки. Эту жидкость получали путём сухой сублимации смеси квасцов, селитры, медного купороса и нашатыря в стеклянном замазанном сосуде. Ёмкость снабжалась колпаком либо стеклянной крышкой.
Альберт великий в своих сочинениях называет царскую водку aqua secunda. Это название означает «вторичная водка». Aqua prima переводится как «первичная водка», что значит азотная кислота. У иных алхимиков формула водки называется aqua regia.
Бонавентура в 1270 году предал огласке свой собственный метод получения чудо-жидкости: он разжижал нашатырь в «крепкой водке» (aqua fortis, азотная кислота). Бонавентура смог установить, что азотная кислота может растворять серебро, отсоединяя его от золота. Он определил, что «царская водка» способна растворить «царя металлов» — золото. А ведь до некоторых пор считалось, что это вещество невозможно подвергнуть изменениям.
Таким образом, появилось наименование aqua regia. Царскую водку стали обозначать алхимическим символом, составленным из знака воды и буквы «R».
Химическая формула
Откройте учебник химии. Или Википедию. Там вы обнаружите такой набор обозначений химических элементов: C2H5OH. Собственно, это и есть формула водки. Означает она следующее. Алкоголь состоит из:
- двух атомов углерода;
- шести атомов водорода;
- одного атома кислорода.
Химики-профессионалы скажут вам, что на само деле все гораздо сложнее, но для нас, простых обывателей, этих знаний будет достаточно, чтобы понимать: в качественной водке не должно быть ничего, кроме двух компонентов – спирта и воды.
Бытует мнение: формулу открыл Дмитрий Менделеев. Нельзя сказать, что это чистая правда: у Менделеева действительно были исследования, касающиеся изучения свойств спирта, соединенного с водой.
Ученый писал об этом докторскую диссертацию. Но никакую «Московскую особенную» он не изобретал и вообще не ставил себе задачу спаивать народ. Он занимался свойствами химических составов, преследуя совершенно иные цели.
Водка известна в мире с XII века. Именно тогда стали получать спиртовые растворы методом дистилляции.
Дистилляция применялась до конца XIX в., а затем появилась методика разведения спирта водой. Спирт используют ректификованный (то есть очищенный).
Водно-спиртовой раствор очищают крахмалом или активированным углем, фильтруют, затем разливают по бутылкам.
И вот она, наша заветная бутылочка, — уже на полке магазина.
Этанол — а именно так звучит одно из его официальных названий — относится к простым спиртам. Он знаком практически всем под теми или иными наименованиями. Часто его называют просто спиртом, иногда прибавляют прилагательные «этиловый» или «винный», химики могут также назвать его метилкарбинолом. Но суть одна — С2Н5ОН.
Кстати, в химии есть много похожих терминов, так что не стоит путать этиловый спирт, например, с этиленом. Последний является бесцветным горючим газом и совсем не похож на прозрачную жидкость с характерным запахом. А еще есть газ этан, и его название тоже созвучно с наименованием «этанол». Но это тоже совсем разные вещества.
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные группы, поэтому химические свойства спиртов определяются взаимодействием друг на друга этих групп.
Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал,с одной стороны, и вещества,содержащего гидроксильную группу и не содержащего углеводородный радикал,-с другой. Такими веществами могут быть,например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами(замещаться на них)
Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов.
Межмолекулярная дегидратация спиртов- отщепление молекулы воды от двух молекул спиртов при нагревании в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры.Так, при нагревании этилового спирта с серной кислотой до температуры от 100 до 140°С образуется диэтиловый (серный) эфир.
Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров( реакция этерификации)Реакция этерификации катализируется сильными неорганическими кислотами. Например, при взаимодействии этилового спирта и уксусной кислоты образуется-этилацетат:
Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры,чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше 140°С в присутствии концентрированной серной кислоты:
Окисление спиртов обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты: При окислении вторичных спиртов образуются кетоны:
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе.
Дегидрирование спиртов. При пропускании паров спирта при 200-300 °С над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
Качественная реакция на многоатомные спирты.
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.
Качественное виноградное вино обладает очень сложным составом, в нем выявлено приблизительно 600 компонентов. Разумеется, на долю воды припадает самое большое количество процентов. Количество экстракта в этом напитке зависит от множества факторов и от вида вина. В белом, к примеру, в среднем его 22г/л, в красном – больше, — примерно 30г/л.
У десертных и крепких вин экстракта еще больше – до 40г/л. Кроме того в продукте переработки виноградного сока содержатся белки, липиды, углеводы, спирт, минеральные соли, микро- и макроэлементы, витамины, полифенолы и прочие вещества. Химический состав виноградного вина таков: спирты – 75-160г/л. Кроме этилового спирта в вине содержатся также другие его виды – амиловый, бутиловый, пропиловый.
Этиловый спирт. Спирт этиловый медицинский
Метиловый (крайне ядовитый) спирт содержится в этом напитке в мизерных количествах; протеины – 1-2г/л; углеводы (фруктоза, глюкоза, сорбитол, глицерол) – 2-3г/л; минеральные соли – калий, магний, кальций, фосфор, натрий и др. – от 50 до1600мг/л; микроэлементы – цинк, медь, феррум, марганец – от 0,1 до 10мг/л; витамины – преимущественно группы В; полифенолы – от 1,2 до 3 г/л.
Образование простых эфиров из спиртов
Если образование алкенов из спиртов формально может рассматриваться как внутримолекулярная дегидратация, то образование простых эфиров из спиртов с этой точки зрения может рассматриваться как межмолекулярная дегидратация. Этот процесс протекает в более мягких условиях по сравне-нию с дегидратацией. При нагревании низших первичных спиртов с 96% серной кислотой при 130 -140 °С преимущественно получаются простые эфиры. Как обычно в кислой среде первой стадией является образование иона алкоксония.
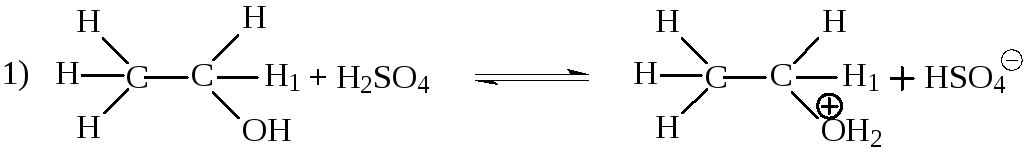
Образование простого эфира происходит в результате нуклеофильного замещения, в котором нуклеофилом является спирт, а субстратом ион алкоксония:
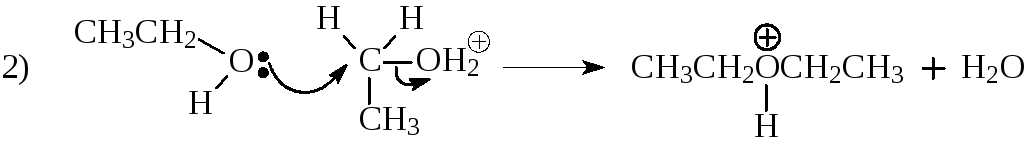
последняя стадия процесса – отщепление протона от сопряжённой кислоты простого эфира при действии основания, роль которого в данной реакции играет гидросульфат-ион
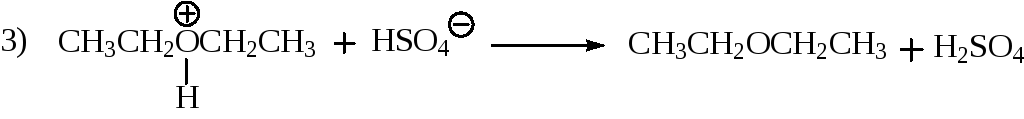
кислота основание основание' кислота'
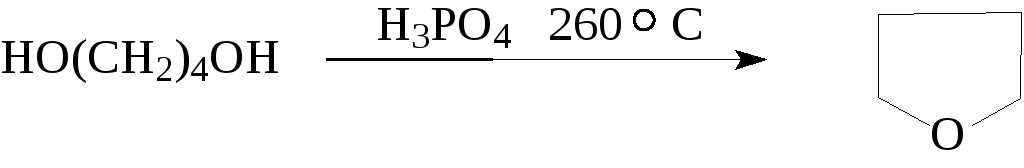
Этим способом получают симетричные простые эфиры - диэтиловый, дипропиловый и дибутиловый эфиры, а также циклические простые эфиры, например, диоксан или тетрагидрофуран.
![]()
Вторичные и третичные спирты в этих условиях дегидратируются с образованием алкенов. Другой недостаток этого способа получения простых эфиров заключается в том, что он неприемлем для получения несимметричных эфиров из двух разных спиртов,
![]()
так как в этом случае образуется смесь трех возможных продуктов R1OR1, R1OR2 и R2OR2, а если радикалы R1 и R2 мало отличаются друг от друга, то разделение трёх продуктов реакции, незначительно отличающихся по своим физическим свойствам (например по т.кип.) превращается в трудоёмкую задачу.
Как для внутри- так и для межмолекулярной дегидратации спиртов, в промышленности, вместо серной кислоты используется в качестве дегидра-тирующего агента безводный оксид алюминия. Гетерогенная каталитическая дегидратация первичных, вторичных и третичных спиртов над окисью алюминия при 350-450 оС приводит к алкенам.
Замещение гидроксила на галоген, образование простых эфиров и отщепление с образованием алкенов – все эти реакции протекают в кислой среде. Как было рассмотрено ранее, во всех трёх процессах спирт сперва пре-вращается в алкоксониевый ион и только после этого происходит гетеролитический разрыв связи C–O, причем в этом случае уходящей группой является вода. Таким образом, роль кислоты в этих реакциях связана с превращением трудно уходящей группы (ОН) в легко уходящую группу- (H2O).
Сорта и виды
Существует множество сортов, видов, марок водки, которые производится в России, странах СНГ, Европе, США. Различные технологии позволяют получить напиток, отличающийся по вкусу, аромату, легкости питья, мягкости, классу спирта. Все сорта в свою очередь делятся на «обыкновенные» (без примесей) и «особые» (с добавками).
Самые знаменитые классические марки – это «Русская» и «Московская» — они изготавливаются из спирта класса «экстра» и имеют количество оборотов 40%. Стандартный процент алкоголя содержат и «Старорусская», «Столичная», «Пшеничная». А вот «Юбилейная» отличается повышенной крепостью в 45 градусов, однако и это не предел – «Крепкая» имеет 56 оборотов. Также многие знаменитые марки водки названы согласно добавкам — «Лимонная», «Перцовка» и т.д.
Бальзам Болотова
Очень многих интересует информация о бальзаме Болотова. Известно, что смесь концентрированных кислот — азотной и соляной — это царская водка. Состав по Болотову – это более слабый раствор. Бальзам, который готовят в аптеках, соответствует 3-процентному раствору кислоты соляной. Поэтому он не оказывает разрушительного воздействия на желудок человека и его принимают внутрь. Какое же воздействие оказывает это средство на организм человека?
Серная кислота растворяет соединительную ткань благодаря превращению сахара в мукополисахариды. Другими словами, она растворяет старые клетки и способствует улучшению пищеварения. Азотная кислота улучшает работу надпочечников и повышает уровень адреналина. Также происходит улучшение питания клеток, где большую роль играет пировиноградная кислота.
Бальзам Болотова способствует образованию в организме витаминов и аминокислот и восстанавливает белковые молекулы. Он благотворно влияет на все процессы, происходящие в организме, и предотвращает воспаления. Бальзам выполняет несколько функций. Во-первых, это увеличение количества новых клеток. Во-вторых, это снижение зашлакованности организма, то есть превращение шлаков в соли и выведение их из организма. Третье — это борьба с микробами и восстановление органов.
Получение альдегидов и кетонов
|
Предельные альдегиды |
||
| Формула |
Тривиальная номенклатура |
Между-народная номенклатура |
|
Муравьиный альдегид (формальдегид) |
Метаналь | |
|
Уксусный альдегид (ацетальдегид) |
Этаналь | |
|
Пропионовый альдегид |
Пропаналь | |
| Масляный альдегид | Бутаналь | |
|
Валерьяновый альдегид |
Пентаналь | |
|
Капроновый альдегид |
Гексаналь | |
|
Непредельные альдегиды |
||
|
Акриловый альдегид |
Пропеналь | |
|
Кротоновый альдегид |
Бутен-2-аль | |
|
Алициклические альдегиды |
||
|
Циклопентан- карбальдегид |
||
|
Циклогексан- карбальдегид |
||
|
Ароматические альдегиды |
||
| Бензальдегид | Бензальдегид | |
|
Со смешанным радикалом (алифатическо-ароматические) |
||
|
Коричный альдегид |
3-фенил-пропеналь |
Кетоны
| Предельные | |||
| Формула |
тривиальная номенклатура |
радикально-функциональная номенклатура |
Между-народная номенклатура |
| Ацетон | Диметилкетон | Пропанон | |
| Непредельные | |||
| Метилвинилкетон | Бутенон | ||
| Алициклические | |||
| Цикло-пентанон | |||
| Ароматические | |||
| Дифенилкетон | |||
|
Смешанный: алифатическо-ароматический |
|||
| Ацетофенон | Метилфенил-кетон | Фенилэтанон |
Калорийность
Вот мы и подошли к самому интересному. При таком простом составе разве имеет напиток собственные калории? Оказывается имеет, и притом побольше, чем огурцы или помидоры: в 100 г крепкого алкоголя содержится 237 Ккал.
Много ли это? В сравнении с шоколадом (500 Ккал на 100 г) – мало, с картофелем вареным (120 Ккал на 100 г) – много. Но тут дело не в количестве.
От водки как таковой поправиться нельзя. Ее калории не оседают на боках в прямом смысле: в напитке нет жиров. Калории здесь представляют собой чистую энергию. Человек, «принявший на грудь», мобилизуется и начинает буквально «кипеть энергией» (пока не переберет).
Организм старается быстро потратить свалившиеся на него невесть откуда энергетические запасы, а переработку собственного жира оставляет «на потом». Поэтому мы вряд ли похудеем, если будем пить домашний алкоголь без закуски.
Еще по теме: Правильное очищение водки в домашних условиях
Кстати, о закуске. В ней-то и таится главная причина вырастания животика после обильных застолий. Выпил водки – получил чистую энергию, которую организм сразу тратит – закусил – приобрел дополнительные запасы жира. Набор веса идет по этой схеме.


Реакционная способность галогеноводородов уменьшается в ряду HI > HBr > HC1 >> HF. Скорость реакции замещения возрастает в ряду первич-ный > вторичный > третичный спирт. Для получения третичных алкилгало-генидов обычно достаточно обработать третичный спирт концентрирован-ным водным раствором соляной, бромистоводородной или йодистоводород-ной кислоты при комнатной температуре. Для получения первичных и вторичных алкилбромидов и алкилйодидов обычно требуется нагревание смеси спирта с концентрированной бромистоводородной или йодисто-водородной кислотой. Вместо концентрированных водных растворов НВr и HI можно использовать бромиды и йодиды натрия или калия и концентрированную серную или фосфорную кислоту. Выходы алкилгалогенидов по этому методу обычно составляют 75—90%. Отдельные примеры приведены ниже.
Первой стадией реакции является образование из спирта иона алкоксония
Следующей стадией для первичных спиртов и некоторых вторичных является SN2 реакция замещения воды в катионе алкоксония на галоген:
для получения алкилхлоридов при взаимодействии первичных спиртов с соляной кислотой используют электрофильный катализатор - безводный хлорид цинка. Смесь соляной кислоты и хлорида цинка носит название реактива Лукаса. В отсутствии катализатора реакция протекает с гораздо меньшей скоростью.
Третичные спирты и некоторые вторичные взаимодействуют с гало-геноводородом по механизму SNl с образованием в качестве интермедиата карбокатиона, который далее с анионом галогена образут конечный продукт.